Nuovi idrogel fisici basati sull’assemblaggio congiunto di FMOC-amminoacidi
Negli ultimi anni gli idrogel fisici sono stati ampiamente studiati a causa delle caratteristiche di queste strutture, rispettivamente delle interazioni non covalenti e della mancanza di altri componenti necessari per i processi di reticolazione. I gelatieri a basso peso molecolare sono una classe di piccole molecole che formano strutture di ordine superiore attraverso legami idrogeno e interazioni π-π. In questo contesto, è noto che la formazione di idrogel a base di amminoacidi FMOC è determinata dalle strutture amminoacidiche primarie e dalla disposizione della struttura secondaria (motivi alfa-elica o beta-foglio).
Lo scopo di questo studio era di ottenere gel supramolecolari attraverso il fenomeno del co-assembly utilizzando aminoacidi FMOC come gelatieri a basso peso molecolare. La stabilità delle nuove strutture è stata valutata utilizzando il test di inversione della fiala, mentre gli spettri FTIR hanno mostrato interazioni tra i composti. La struttura gelatinosa è confermata dai parametri viscoelastici nelle condizioni di taglio oscillatorio. La microscopia SEM è stata utilizzata per ottenere una visione visiva della morfologia della rete fisica dell’idrogel, mentre le misurazioni DLS hanno rivelato una transizione sol-gel. La disposizione molecolare dei gel è stata determinata mediante dicroismo circolare, fluorescenza e spettroscopia UV-Vis.
FMOC IDROXYAPATITE IDROGEL DECORATIVO COME SUBSTRATO IMITAZIONE OSSEA PER LA DIFFERENZA E LA COLTIVAZIONE DI OSTICLASTS
Gli idrogel sono reti gonfie d’acqua con un grande potenziale per applicazioni di ingegneria tissutale. Tuttavia, il loro utilizzo nella rigenerazione ossea è spesso ostacolato dalla mancanza di mineralizzazione dei materiali e dalle scarse proprietà meccaniche. Inoltre, la maggior parte della ricerca si è concentrata sugli osteoblasti (ESR) per la formazione dell’osso, mentre gli osteoclasti (OC), le cellule coinvolte nel riassorbimento osseo, sono spesso trascurati . Tuttavia, il ruolo dell’OC è cruciale per l’omeostasi ossea e un’attività anormale dell’OC è stata segnalata in diverse malattie patologiche come l’osteoporosi e il cancro alle ossa. Per questi motivi, lo scopo di questo lavoro è sviluppare idrogel fortificati su misura da utilizzare come piattaforma materiale per studiare la funzione cellulare, le interazioni intercellulari e, infine, fornire un substrato per la differenziazione e la coltura di OC.
- In questo caso, gli idrogel peptidici a base di Fmoc a base di RGD sono stati modificati con nanopolvere di idrossiapatite (Hap) come nanofiller per creare idrogel nanocompositi.
- La microscopia a forza atomica ha mostrato che le nanoparticelle Hap adornano le nanofibre peptidiche con uno schema ripetitivo, risultando in idrogel più rigidi con proprietà meccaniche migliorate rispetto ai controlli senza Hap e RGD.
- Inoltre, questi nanocompositi hanno supportato l’adesione di macrofagi grezzi 264.7 e la loro differenziazione 2D in OC maturi, definiti adottando la tipica morfologia OC (presenza di un anello di actina, multinucleazione e membrana plasmatica rugosa). Infine, dopo 7 giorni di coltura, gli OC hanno mostrato una maggiore espressione di TRAP, un tipico marcatore di differenziazione degli OC.
- Presi insieme, i risultati suggeriscono che l’idrogel Hap / Fmoc-RGD ha il potenziale per l’ingegneria del tessuto osseo come modello 2D per studiare la compromissione o la sovraregolazione della differenziazione OC.
- SIGNIFICATO: L’alterata funzione degli osteoclasti (OC) è una delle principali cause di fratture ossee nelle malattie più comuni dell’apparato scheletrico (es. osteoporosi).
- Gli idrogel peptidici possono fungere da piattaforma per imitare il microambiente osseo e fornire uno strumento per valutare la differenziazione e la funzione di OC.
- Inoltre, gli idrogel possono contenere vari nanofiller per ottenere biomateriali ibridi con proprietà meccaniche migliorate e migliore citocompatibilità.
- Qui, gli idrogel peptidici a base di Fmoc a base di RGD sono stati decorati con nanoparticelle di idrossiapatite (Hap) per generare un idrogel con proprietà reologiche migliorate.
- Inoltre, sono in grado di supportare l’osteoclastogenesi delle cellule Raw264.7 in vitro, come confermato dai cambiamenti morfologici e dall’espressione dei marcatori OC. Pertanto, questo idrogel decorato con Hap può essere utilizzato come modello per l’efficace differenziazione di OC e potenzialmente per lo studio della disfunzione
Sintesi ottimizzata di Fmoc-1-omopropargillicina-OH
È stata descritta l’efficiente sintesi multi-grammo dell’amminoacido alchinile Fmoc-1-omopropargillicina-OH. La doppia protezione Boc è ottimizzata per un’elevata produttività di materiale e l’omologazione chiave Seyferth-Gilbert è ottimizzata per evitare la racemizzazione. Diciotto grammi di amminoacido non canonico enantiomericamente puro (> 98% ee) sono stati prontamente preparati per l’uso nella sintesi in fase solida per produrre peptidi che potrebbero essere funzionalizzati mediante cicloaddizione assistita da rame di alchinazidi.
Auto-organizzazione di Fmoc – aminoacidi in uno spazio capillare limitato creando una rete parallela ordinata di fibre da utilizzare nella vascolarizzazione
Le matrici risultanti dall’autorganizzazione degli amminoacidi e dei loro derivati sono idonee alla diffusione, migrazione e proliferazione delle cellule e trovano largo impiego nell’ingegneria tissutale e nella rigenerazione degli organi a causa delle molecole biologiche endogene e delle deboli forze intermolecolari. Il processo di autoassemblaggio è influenzato non solo da fattori dinamici e termodinamici, ma anche dallo spazio da installare. In questo lavoro, sono stati selezionati tubi capillari di diverso diametro per imitare l’ambiente chiuso e studiato l’effetto dello spazio capillare sul comportamento di auto -organizzazione degli amminoacidi Fmoc con diversi coefficienti di partizione olio-acqua (log P).
Gli amminoacidi possono creare particolari morfologie e strutture limitando il moto browniano e l’effetto matrice esercitato dall’ambiente chiuso.
Nel frattempo, la rete di fibre ordinate parallele risultante è stata utilizzata per imitare la matrice extracellulare (ECM) e per promuovere l’adesione e la proliferazione delle cellule epiteliali squamose (HUVEC). Riteniamo che lo studio dell’auto-organizzazione degli amminoacidi in spazi confinati possa aiutare a comprendere il meccanismo supramolecolare dell’autoassemblaggio e offrire grandi opportunità per costruire specifiche strutture di vasi o tessuti in vitro .
Nanozima Pt auto-organizzante in idrogel Fmoc-difenilalanina per superare la limitazione del pH ossidasi e perossidasi-simile per un potenziale uso antimicrobico
I nanomateriali ossidasi e simili alla perossidasi hanno un potenziale nella terapia antimicrobica. L’attività ottimale della maggior parte dei nanozimi si è verificata a pH acido (3,0-5,0), mentre il pH nei sistemi biologici è per lo più vicino al neutro. Qui viene proposto un sistema generale che utilizza 9-fluorenilmetossicarbonil difenilalanina modificata (FmocFF) idrogel per migliorare le attività ossidasi e perossidasi di Pt NP e altri nanomateriali simili a enzimi convenzionali a pH neutro o addirittura alcalino.
In questo sistema, l’idrogel Fmoc-FF fornisce un microambiente acido per le nanoparticelle di Pt a causa dei protoni idrogeno (H +) prodotti dalla dissociazione di F a pH neutro. Di conseguenza, le Pt NP mostrano un’attività simile all’ossidasi aumentata di 6 volte e simile all’attività della perossidasi dopo l’incapsulamento in un idrogel Fmoc-FF a pH 7,0. L’idrogel Pt-Fmoc-FF, basato sull’eccezionale attività enzimatica e antibatterica dell’idrogel Fmoc-FF stesso, mostra eccellenti proprietà antibatteriche. Questo progetto fornisce una strategia universale per superare i limiti di pH dei nanozimi e promuove le applicazioni biologiche dei nanozimi.
Sintesi proteica chimica one-pot utilizzando selenazolidina Fmoc mascherata per affrontare la funzione redox della selenoproteina F umana
Il SELENOF umano è una selenoproteina del reticolo endoplasmatico (ER) che contiene il motivo redox attivo CXU (C è cisteina e U è selenocisteina), simile al motivo redox delle tiol disolfuro ossidoreduttasi (CXXC). Come con altre selenoproteine, la sfida nell’accesso a SEENOF ha limitato in qualche modo la sua completa caratterizzazione biologica finora. Qui presentiamo la sintesi chimica one-pot del dominio simile alla tioredossina di SELENOF, sottolineata dall’uso di selenazolidina protetta da Fmoc, legatura chimica nativa e reazioni di deselenizzazione.
Il potenziale redox del motivo CXU insieme a un test turbidimetrico dell’insulina ha suggerito che SELENOF potrebbe catalizzare la riduzione dei disolfuri nelle proteine mal ripiegate. Inoltre, mostriamo che SEENOF non è un enzima simile alla disolfuro isomerasi (PDI) in quanto non migliora il ripiegamento dei due modelli proteici; inibitore della tripsina pancreatica bovina e irudina. Questi studi suggeriscono che SELENOF potrebbe essere responsabile della riduzione dei legami disolfuro non nativi delle glicoproteine mal ripiegate come parte del sistema di controllo della qualità nel pronto soccorso.
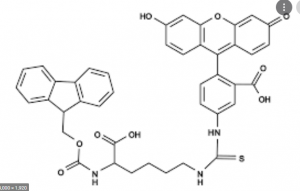
Riviste pluripremiate di Thieme Chemistry Journals: dove sono ora? Metodi migliorati di deprotezione Fmoc nella sintesi di peptidi e proteine contenenti tioamide
Fmoc-Lys(Fmoc)-OH |
|||
| 5-06663 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys(Fmoc)-OH |
|||
| 5-06664 | CHI Scientific | 100g | Ask for price |
Fmoc-Lys(Fmoc)-OH |
|||
| A7928-100000 | ApexBio | 100 g | 137 EUR |
Fmoc-Lys(Fmoc)-OH |
|||
| A7928-25000 | ApexBio | 25 g | 69 EUR |
Fmoc-Lys(Fmoc)-OH |
|||
| 4011122.0005 | Bachem | 5 g | 75.29 EUR |
Fmoc-Lys(Fmoc)-OH |
|||
| 4011122.0025 | Bachem | 25 g | 289.91 EUR |
Fmoc-Lys(Fmoc)-OH |
|||
| 4011122.01 | Bachem | 100 g | 870.77 EUR |
Fmoc-Lys(Fmoc)-OH |
|||
| B-1610.0005 | Bachem | 5.0g | 151.2 EUR |
Fmoc-Lys(Fmoc)-OH |
|||
| B-1610.0025 | Bachem | 25.0g | 486 EUR |
Fmoc-Lys(Fmoc)-OH |
|||
| B-1610.0100 | Bachem | 100.0g | 1387.2 EUR |
Fmoc-Lys(Boc)-Lys(Boc)-OH |
|||
| 5-06655 | CHI Scientific | 1g | Ask for price |
Fmoc-Lys(Boc)-Lys(Boc)-OH |
|||
| 5-06656 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys-OH |
|||
| 5-06629 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys-OH |
|||
| 5-06630 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys-OH |
|||
| A7916-100000 | ApexBio | 100 g | 285 EUR |
Fmoc-Lys-OH |
|||
| A7916-5000 | ApexBio | 5 g | 39 EUR |
Fmoc-Lys(ivdde)-Lys(ivdde)-OH |
|||
| 5-06683 | CHI Scientific | 1g | Ask for price |
Fmoc-Lys(ivdde)-Lys(ivdde)-OH |
|||
| 5-06684 | CHI Scientific | 5g | Ask for price |
Fmoc-L-Lys(Fmoc)-OH |
|||
| 20-abx095059 | Abbexa |
|
|
Fmoc-D-Lys(Fmoc)-OH |
|||
| 5-06733 | CHI Scientific | 5g | Ask for price |
Fmoc-D-Lys(Fmoc)-OH |
|||
| 5-06734 | CHI Scientific | 25g | Ask for price |
Fmoc-D-Lys(Fmoc)-OH |
|||
| 4027404.0001 | Bachem | 1 g | 62.9 EUR |
Fmoc-D-Lys(Fmoc)-OH |
|||
| 4027404.0005 | Bachem | 5 g | 210.11 EUR |
Fmoc-D-Lys(Fmoc)-OH |
|||
| 4027404.0025 | Bachem | 25 g | 835.91 EUR |
Fmoc-D-Lys(Fmoc)-OH |
|||
| B-3050.0001 | Bachem | 1.0g | 135.6 EUR |
Fmoc-D-Lys(Fmoc)-OH |
|||
| B-3050.0005 | Bachem | 5.0g | 360 EUR |
Fmoc-D-Lys(Fmoc)-OH |
|||
| B-3050.0025 | Bachem | 25.0g | 1333.2 EUR |
Fmoc-L-Lys(Fmoc)-OH |
|||
| abx095059-100l | Abbexa | 100 µl | 312.5 EUR |
Fmoc-L-Lys(Fmoc)-OH |
|||
| abx095059-1ml | Abbexa | 1 ml | Ask for price |
Fmoc-L-Lys(Fmoc)-OH |
|||
| abx095059-200l | Abbexa | 200 µl | 762.5 EUR |
Fmoc-Lys(Bz)-OH |
|||
| 5-06657 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Bz)-OH |
|||
| 5-06658 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys(Z)-OH |
|||
| 5-06671 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Z)-OH |
|||
| 5-06672 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys(Ac)-OH |
|||
| 5-06675 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Ac)-OH |
|||
| 5-06676 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys(Ac)-OH |
|||
| 4034189.0001 | Bachem | 1 g | 65.21 EUR |
Fmoc-Lys(Ac)-OH |
|||
| 4034189.0005 | Bachem | 5 g | 224.7 EUR |
Fmoc-Lys(Ac)-OH |
|||
| 4034189.0025 | Bachem | 25 g | 899.96 EUR |
Fmoc-Lys(Z)-OH |
|||
| 4004133.0005 | Bachem | 5 g | 65.21 EUR |
Fmoc-Lys(Z)-OH |
|||
| 4004133.0025 | Bachem | 25 g | 261.77 EUR |
Fmoc-Lys(Z)-OH |
|||
| B-1270.0005 | Bachem | 5.0g | 138 EUR |
Fmoc-Lys(Z)-OH |
|||
| B-1270.0025 | Bachem | 25.0g | 441.6 EUR |
Fmoc-Lys(Ac)-OH |
|||
| B-3520.0001 | Bachem | 1.0g | 138 EUR |
Fmoc-Lys(Ac)-OH |
|||
| B-3520.0005 | Bachem | 5.0g | 385.2 EUR |
Fmoc-Lys(Ac)-OH |
|||
| B-3520.0025 | Bachem | 25.0g | 1430.4 EUR |
Fmoc-Lys(Boc)-OH |
|||
| 5-06639 | CHI Scientific | 1g | Ask for price |
Fmoc-Lys(Boc)-OH |
|||
| 5-06640 | CHI Scientific | 10g | Ask for price |
Fmoc-Lys(Nic)-OH |
|||
| 5-06667 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Nic)-OH |
|||
| 5-06668 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys(Dde)-OH |
|||
| 5-06679 | CHI Scientific | 1g | Ask for price |
Fmoc-Lys(Dde)-OH |
|||
| 5-06680 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(For)-OH |
|||
| 5-06687 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(For)-OH |
|||
| 5-06688 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys(Dnp)-OH |
|||
| 5-06695 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Dnp)-OH |
|||
| 5-06696 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys(ipr)-OH |
|||
| 5-06697 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(ipr)-OH |
|||
| 5-06698 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys(Mmt)-OH |
|||
| 5-06703 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Mmt)-OH |
|||
| 5-06704 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys(Mtt)-OH |
|||
| 5-06705 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Mtt)-OH |
|||
| 5-06706 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys(Tfa)-OH |
|||
| 5-06713 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Tfa)-OH |
|||
| 5-06714 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys(Trt)-OH |
|||
| 5-06715 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Trt)-OH |
|||
| 5-06716 | CHI Scientific | 25g | Ask for price |
FMOC-Lys(TQ2)-OH |
|||
| 5256 | AAT Bioquest | 100 mg | 341 EUR |
FMOC-Lys(TQ2)-OH |
|||
| 5256-100mg | AAT Bioquest | 100 mg | 334 EUR |
FMOC-Lys(TQ3)-OH |
|||
| 5258 | AAT Bioquest | 100 mg | 341 EUR |
FMOC-Lys(TQ3)-OH |
|||
| 5258-100mg | AAT Bioquest | 100 mg | 334 EUR |
Fmoc-Lys(Boc)-OH |
|||
| A7922-100000 | ApexBio | 100 g | 67 EUR |
Fmoc-Lys(Boc)-OH |
|||
| A7922-25000 | ApexBio | 25 g | 29 EUR |
Fmoc-Lys(Dnp)-OH |
|||
| A7926-1000 | ApexBio | 1 g | 102 EUR |
Fmoc-Lys(Dnp)-OH |
|||
| A7926-25000 | ApexBio | 25 g | 410 EUR |
Fmoc-Lys(Dnp)-OH |
|||
| A7926-5000 | ApexBio | 5 g | 205 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| A7930-25000 | ApexBio | 25 g | 384 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| A7930-5000 | ApexBio | 5 g | 96 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| 4025724.0001 | Bachem | 1 g | 77.49 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| 4025724.0005 | Bachem | 5 g | 270.8 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| 4025724.0025 | Bachem | 25 g | 947.1 EUR |
Fmoc-Lys(Dnp)-OH |
|||
| 4026832.1 | Bachem | 1 g | 589.89 EUR |
Fmoc-Lys(Dde)-OH |
|||
| 4027144.0001 | Bachem | 1 g | 181.97 EUR |
Fmoc-Lys(Dde)-OH |
|||
| 4027144.0005 | Bachem | 5 g | 728.07 EUR |
Fmoc-Lys(For)-OH |
|||
| 4014975.0005 | Bachem | 5 g | 261.77 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| 4154783.0001 | Bachem | 1 g | 72.45 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| 4154783.0005 | Bachem | 5 g | 253.05 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| 4154783.0025 | Bachem | 25 g | 885.15 EUR |
Fmoc-Lys(Boc)-OH |
|||
| 4003151.0025 | Bachem | 25 g | 99.96 EUR |
Fmoc-Lys(Boc)-OH |
|||
| 4003151.01 | Bachem | 100 g | 299.99 EUR |
Fmoc-Lys(Boc)-OH |
|||
| 4003151.05 | Bachem | 500 g | 1199.94 EUR |
Fmoc-Lys(For)-OH |
|||
| 20-abx184083 | Abbexa |
|
|
Fmoc-Lys(Tfa)-OH |
|||
| 20-abx184084 | Abbexa |
|
|
Fmoc-Lys(Boc)-OH |
|||
| B-1080.0025 | Bachem | 25.0g | 192 EUR |
Fmoc-Lys(Boc)-OH |
|||
| B-1080.0100 | Bachem | 100.0g | 501.6 EUR |
Fmoc-Lys(Boc)-OH |
|||
| B-1080.0500 | Bachem | 500.0g | 1897.2 EUR |
Fmoc-Lys(For)-OH |
|||
| B-1865.0001 | Bachem | 1.0g | 138 EUR |
Fmoc-Lys(For)-OH |
|||
| B-1865.0005 | Bachem | 5.0g | 441.6 EUR |
Fmoc-Lys(For)-OH |
|||
| B-1865.0025 | Bachem | 25.0g | 1632 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| B-2535.0001 | Bachem | 1.0g | 138 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| B-2535.0005 | Bachem | 5.0g | 297.6 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| B-2535.0025 | Bachem | 25.0g | 1082.4 EUR |
Fmoc-Lys(Dnp)-OH |
|||
| B-2885.0250 | Bachem | 250.0mg | 340.8 EUR |
Fmoc-Lys(Dnp)-OH |
|||
| B-2885.1000 | Bachem | 1.0g | 950.4 EUR |
Fmoc-Lys(Dde)-OH |
|||
| B-3015.0001 | Bachem | 1.0g | 318 EUR |
Fmoc-Lys(Dde)-OH |
|||
| B-3015.0005 | Bachem | 5.0g | 1164 EUR |
Fmoc-Lys(Nde)-OH |
|||
| B-3380.0001 | Bachem | 1.0g | 292.8 EUR |
Fmoc-Lys(Nde)-OH |
|||
| B-3380.0005 | Bachem | 5.0g | 1039.2 EUR |
Fmoc-Lys(Mca)-OH |
|||
| B-3590.0001 | Bachem | 1.0g | 835.2 EUR |
Fmoc-Lys(Mca)-OH |
|||
| B-3590.0005 | Bachem | 5.0g | 3228 EUR |
FMOC-Lys(TF3)-OH |
|||
| 5051-100mg | AAT Bioquest | 100 mg | 558 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| GM6452-5 | Glentham Life Sciences | 5 | 189.8 EUR |
Fmoc-Lys(Mtt)-OH |
|||
| GM6452-5G | Glentham Life Sciences | 5 g | 184.8 EUR |
Fmoc-Lys(Boc)-OH |
|||
| GM7550-10 | Glentham Life Sciences | 10 | 31.7 EUR |
Fmoc-Lys(Boc)-OH |
|||
| GM7550-100 | Glentham Life Sciences | 100 | 189.8 EUR |
Fmoc-Lys(Boc)-OH |
|||
| GM7550-100G | Glentham Life Sciences | 100 g | 265.2 EUR |
Fmoc-Lys(Boc)-OH |
|||
| GM7550-10G | Glentham Life Sciences | 10 g | 74.4 EUR |
Fmoc-Lys(Boc)-OH |
|||
| GM7550-25 | Glentham Life Sciences | 25 | 67.2 EUR |
Fmoc-Lys(Boc)-OH |
|||
| GM7550-25G | Glentham Life Sciences | 25 g | 117.6 EUR |
Fmoc-Lys(Boc)-OH |
|||
| GM7550-50 | Glentham Life Sciences | 50 | 118.7 EUR |
Fmoc-Lys(Boc)-OH |
|||
| GM7550-50G | Glentham Life Sciences | 50 g | 180 EUR |
Fmoc-Lys(Teoc)-OH |
|||
| 5-06711 | CHI Scientific | 1g | Ask for price |
Fmoc-Lys(Teoc)-OH |
|||
| 5-06712 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Aloc)-OH |
|||
| 4016656.0005 | Bachem | 5 g | 82.01 EUR |
Fmoc-Lys(Aloc)-OH |
|||
| 4016656.0025 | Bachem | 25 g | 309.02 EUR |
Fmoc-Lys(Aloc)-OH |
|||
| B-2240.0005 | Bachem | 5.0g | 163.2 EUR |
Fmoc-Lys(Aloc)-OH |
|||
| B-2240.0025 | Bachem | 25.0g | 514.8 EUR |
Fmoc-Lys(ivDde)-OH |
|||
| 5-06681 | CHI Scientific | 1g | Ask for price |
Fmoc-Lys(ivDde)-OH |
|||
| 5-06682 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Alloc)-OH |
|||
| 5-06685 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Alloc)-OH |
|||
| 5-06686 | CHI Scientific | 25g | Ask for price |
Fmoc-Lys(ivDde)-OH |
|||
| A7927-1000 | ApexBio | 1 g | 104 EUR |
Fmoc-Lys(ivDde)-OH |
|||
| A7927-5000 | ApexBio | 5 g | 392 EUR |
Fmoc-Lys(ivDde)-OH |
|||
| 4034540.0001 | Bachem | 1 g | 206.75 EUR |
Fmoc-Lys(ivDde)-OH |
|||
| 4034540.0005 | Bachem | 5 g | 814.59 EUR |
Fmoc-Lys-OH · HCl |
|||
| 4014974.0001 | Bachem | 1 g | 65.21 EUR |
Fmoc-Lys-OH · HCl |
|||
| 4014974.0005 | Bachem | 5 g | 159.5 EUR |
Fmoc-Lys-OH · HCl |
|||
| 4014974.0025 | Bachem | 25 g | 628.01 EUR |
Fmoc-Lys-OH · HCl |
|||
| B-1870.0001 | Bachem | 1.0g | 138 EUR |
Fmoc-Lys-OH · HCl |
|||
| B-1870.0005 | Bachem | 5.0g | 283.2 EUR |
Fmoc-Lys-OH · HCl |
|||
| B-1870.0025 | Bachem | 25.0g | 1009.2 EUR |
Fmoc-Lys(Adpoc)-OH |
|||
| B-2520.0001 | Bachem | 1.0g | 360 EUR |
Fmoc-Lys(Adpoc)-OH |
|||
| B-2520.0005 | Bachem | 5.0g | 1333.2 EUR |
Fmoc-Lys(ivDde)-OH |
|||
| B-3515.0001 | Bachem | 1.0g | 356.4 EUR |
Fmoc-Lys(ivDde)-OH |
|||
| B-3515.0005 | Bachem | 5.0g | 1298.4 EUR |
Fmoc-Lys(Alloc)-OH |
|||
| GM9940-5 | Glentham Life Sciences | 5 | 134.4 EUR |
Fmoc-Lys(Dansyl)-OH |
|||
| 5-06661 | CHI Scientific | 250mg | Ask for price |
Fmoc-Lys(Dansyl)-OH |
|||
| 5-06662 | CHI Scientific | 1g | Ask for price |
Fmoc-Lys(Biotin)-OH |
|||
| 5-06677 | CHI Scientific | 1g | Ask for price |
Fmoc-Lys(Biotin)-OH |
|||
| 5-06678 | CHI Scientific | 5g | Ask for price |
Fmoc-Lys(Dabcyl)-OH |
|||
| 5-06693 | CHI Scientific | 250mg | Ask for price |
Fmoc-Lys(Dabcyl)-OH |
|||
| 5-06694 | CHI Scientific | 1g | Ask for price |
Fmoc-Lys(Dabsyl)-OH |
|||
| 4050342.0001 | Bachem | 1 g | 561.75 EUR |
×
L’incorporazione selettiva del sito di tioamidi in peptidi e proteine fornisce uno strumento utile per un’ampia gamma di applicazioni. Gli attuali metodi di introduzione hanno una bassa efficienza così come l’epimerizzazione.
Qui descriviamo come l’uso di 1,8-diazabicyclo [5.4.0] undec-7-ene (DBU) invece della piperidina nella deprotezione del fluorenilmetilossicarbonile (Fmoc) riduce l’epimerizzazione e aumenta la resa di peptidi contenenti tioammide. Inoltre, mostriamo che l’uso di DBU evita la formazione di sottoprodotti durante la sintesi di peptidi contenenti tioamidi nella catena laterale.
